Our Business
私たちが取り組む社会課題と事業の特徴についてご紹介します
パーパス
神経・精神疾患に関わる社会課題を解決する
アキュリスファーマのパーパス(存在意義)は、神経・精神疾患における革新的な医療手段への橋渡し役となり、患者さんやご家族、医療関係者、社会により良い医療を届けることです。海外で承認されている革新的な医薬品を日本に導入することで、アンメットメディカルニーズの解消に取り組んでいます。
アキュリスファーマが取り組む社会課題
患者さんが直面している「ドラッグ・ラグ」
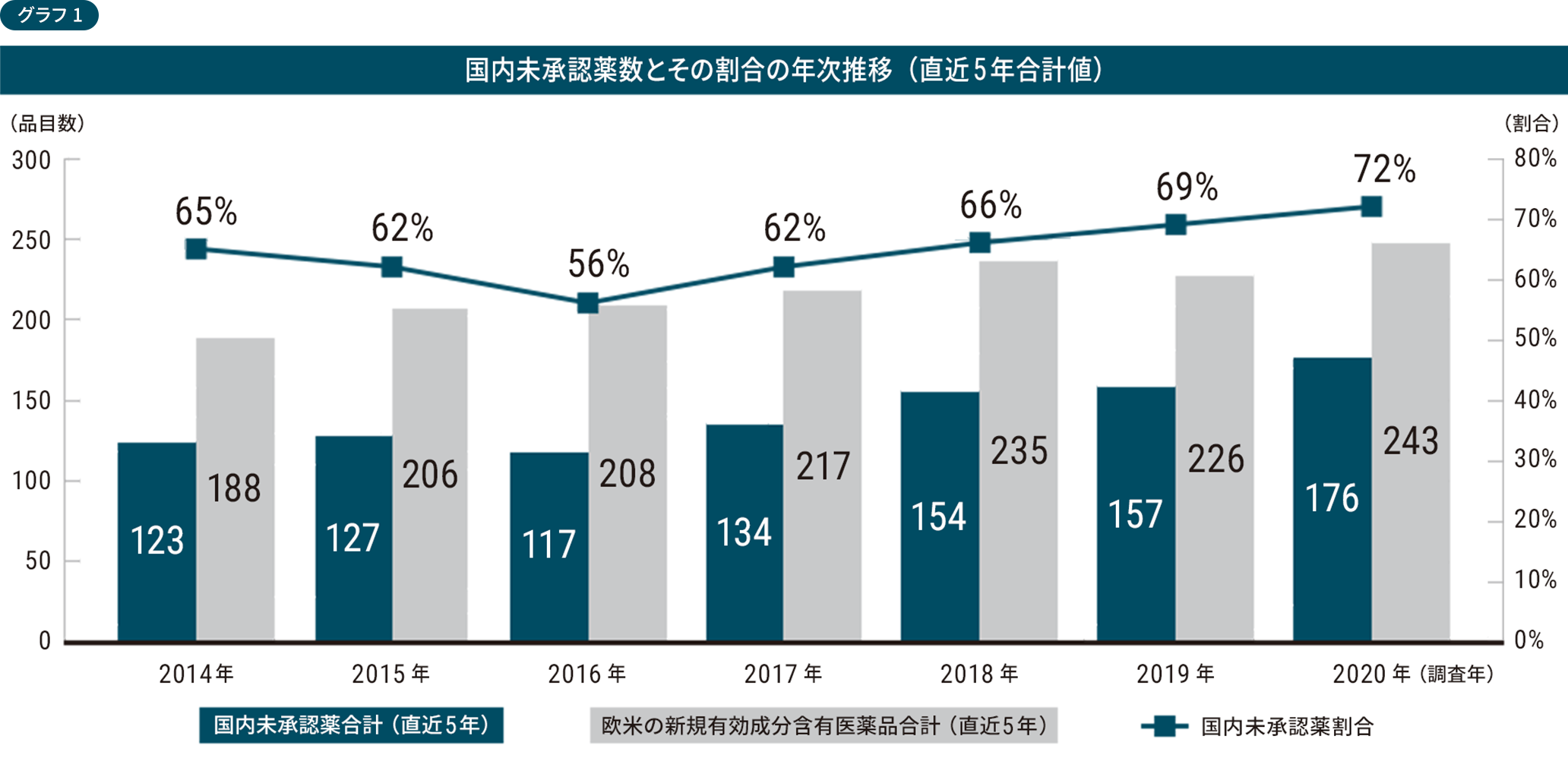
海外で使われている医薬品が日本では承認が遅れていて使えない「ドラッグ・ラグ」が、治療を阻む壁となっています。実際、日本における未承認薬は2016年から増加傾向に転じています。
日本と欧米で新有効成分含有医薬品の承認状況を比較した調査によれば、直近5年の未承認薬の数は、2020年時点で欧米新薬全体の72%にあたる176品目に上ります※。海外で使われている薬が日本では使えないために、困難を抱えている患者さんがいます。
※医薬産業政策研究所「ドラッグ・ラグ:国内未承認薬の状況とその特徴」政策研ニュースNo.63 (2021年07月発行)
https://www.jpma.or.jp/opir/news/066/02.html
国内で新薬が開発されない「ドラッグ・ロス」
2020年時点で未承認だった176品目のうち、2023年時点で承認されたものは33品目であり、143品目が未承認です。かつそのうちの86品目は開発が着手されていない「ドラッグロス」の状態にあります。
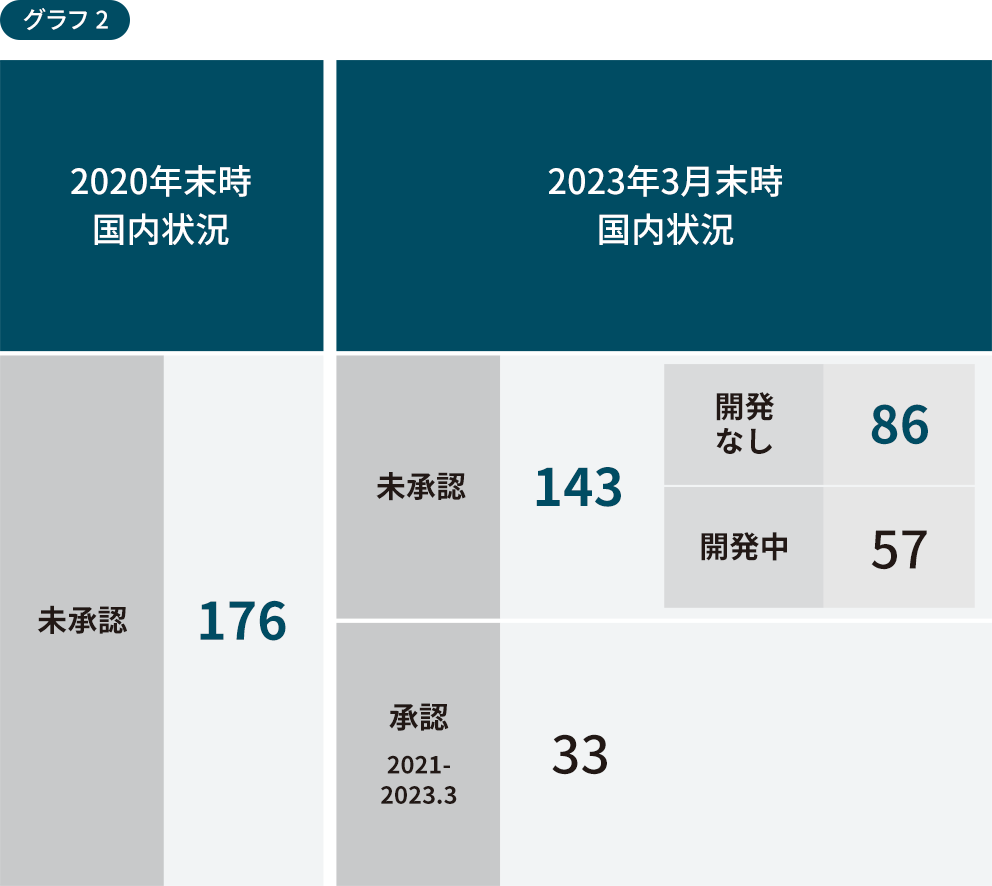
出典:医薬産業政策研究所「2023年度 医薬品評価委員会総会シンポジウム ドラッグ・ラグ/ドラッグ・ロスの現状」
https://www.jpma.or.jp/information/evaluation/symposium/bbh7c90000001esq-att/2023_11_17_02.pdf
ドラッグロスの86品目の内訳は、新興企業により開発された品目、オーファン、小児のカテゴリーが全体の84%を占めます。また、青字で示されている通り、ドラッグロス品目は新規性の高い薬剤が多く含まれています。

出典:医薬産業政策研究所「2023年度 医薬品評価委員会総会シンポジウム ドラッグ・ラグ/ドラッグ・ロスの現状」
https://www.jpma.or.jp/information/evaluation/symposium/bbh7c90000001esq-att/2023_11_17_02.pdf
近年、ベンチャー企業が新薬の創薬、そして開発の担い手として台頭しています。
米国における2023年の新薬の創出の56%が、またその上市の53%はEBP(新興バイオ医薬品企業)によるものでした※1。
年によって変動はあるものの、EBPによる新薬創出や上市は増える傾向です。しかし、資金力のないベンチャー企業‧中小製薬企業は、日本市場での展開を予定しないケースも多く、承認が遅れるのみならず、そもそも新薬が日本に入ってこない「ドラッグ・ロス」が懸念されています。結果として日本におけるドラッグラグやドラッグロスの課題は今後も増大し続けるリスクを示唆しています。
※1 IQVIA Japan Facebook
https://www.facebook.com/photo.php?fbid=813894004178273&id=100066730410677&set=a.451742297060114
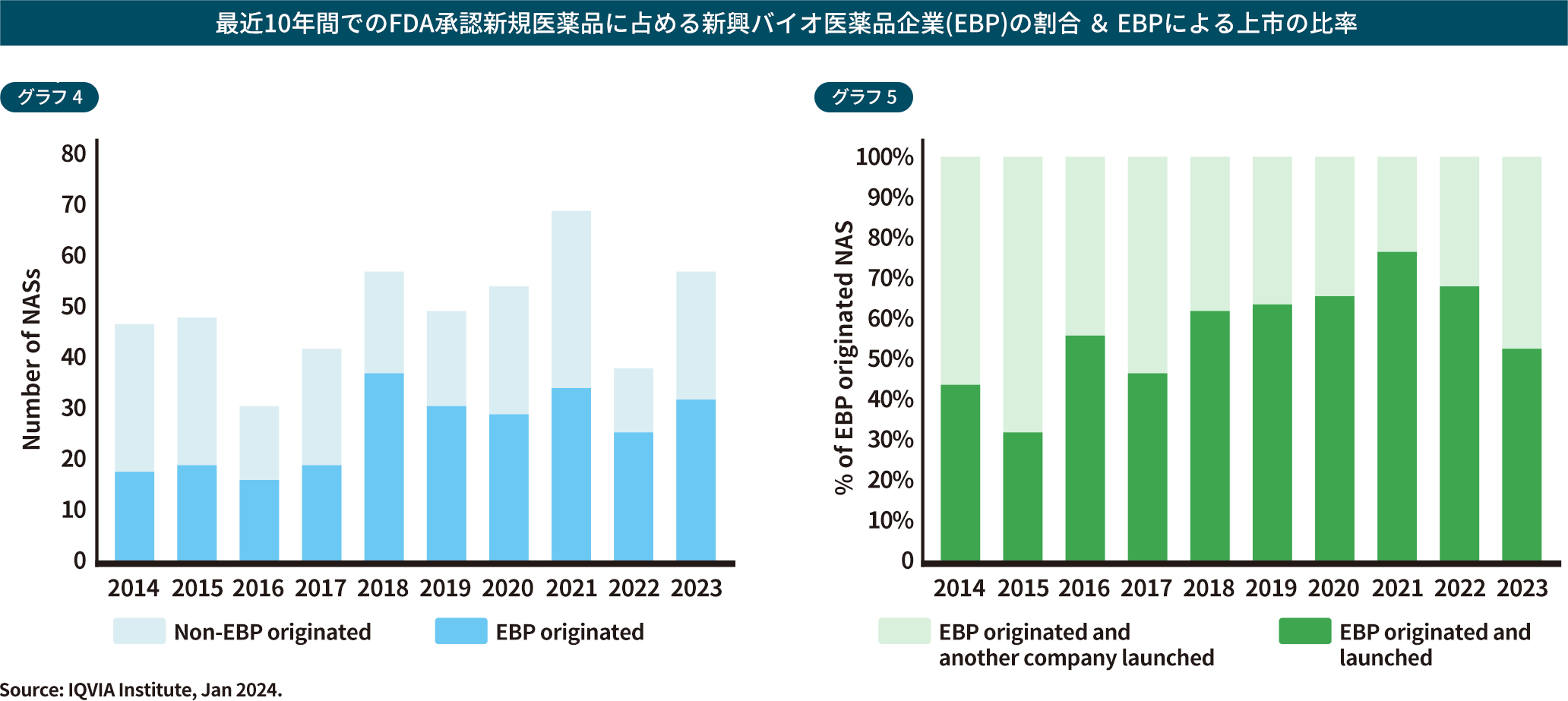
出典:IQVIA INSTITUTE , Global Trends in R&D 2024をもとに当社作成
https://www.iqvia.com/insights/the-iqvia-institute/reports-and-publications/reports/global-trends-in-r-and-d-2024-activity-productivity-and-enablers
未着手の問題が残る「神経・精神疾患領域」
神経・精神疾患において、欧米で承認されていても国内で未承認の新薬の数は2016年の11品目から2020年の22品目へと倍増しており※1増加の一途をたどっています。さらに治療満足度、薬剤貢献度がいずれも50%以下の疾患が相対的に多く※2、依然として大きなアンメットメディカルニーズ(いまだ満たされていない医療ニーズ)の残された領域です。
治療選択肢の不足だけでなく、診断の遅れによる社会生活への影響、家族や介護者の負担など、社会経済的な面からも解決すべき課題は多岐に渡ります。
※1 医薬産業政策研究所「ドラッグ・ラグ:未承認薬は日本のアンメット・メディカル・ニーズに応えうるか?」政策研ニュースNo.66 (2022年07月発行)
https://www.jpma.or.jp/opir/news/066/02.html
※2 2021年度 国内基盤技術調査報告書(明治薬科大学 社会薬学研究室 日本製薬工業協会 医薬産業政策研究所)
https://u-lab.my-pharm.ac.jp/~soc-pharm/achievements/img/index/r03.pdf
パイプライン
神経・精神疾患領域において、現在3つの適応症のパイプラインを構築しています。いち早く日本の患者さんのアンメットメディカルニーズを満たすため、海外では既に使用が承認されているのに国内では承認されていない薬剤の開発に着手しています。